
Лектор профессор Долженко Юрий Иванович
Тел. раб. 70-76-683 70-76-827
Дисциплина «Физическая химия»
Двухсеместровый курс
Контрольная работа за IV семестр по теме
«Электрохимия. Химическая кинетика»
Контрольная работа состоит из четырех заданий:
Внимание! Номера вариантов заданий контрольной работы указываются преподавателем!
Задание 1
На основании приведенных в табл.1 данных о свойствах водных растворов вещества А выполните следующие задания.
- Постройте график зависимости удельной и эквивалентной электрических проводимостей от разведения.
- Проверьте, подчиняется ли водный раствор вещества А закону разведения Оствальда.
- Если раствор вещества является раствором слабой кислоты или слабого основания, определите, при какой концентрации степень диссоциации вещества в растворе равна 0,1 и чему равен рН данного раствора.
- Если раствор является сильной кислотой или основанием, вычислите для него рН при С = 0,1 кмоль/м3 с учетом ионной силы раствора.
- Для слабого электролита вычислите константу диссоциации КД и эквивалентную электрическую проводимость при бесконечном разведении, не используя при этом данных о подвижностях ионов.
- Для сильного электролита на основании зависимости эквивалентной электрической проводимости от
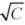 , которая дается уравнением Кольрауша
, которая дается уравнением Кольрауша 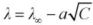 , рассчитайте эквивалентную электрическую проводимость при бесконечном разведении и постоянную уравнения графическим методом.
, рассчитайте эквивалентную электрическую проводимость при бесконечном разведении и постоянную уравнения графическим методом. - Для слабых кислот и оснований рассчитайте теплоту диссоциации и при одной из температур – изменение энергии Гельмгольца (ΔF) при диссоциации.
Задание 2
Для реакции, протекающей обратимо в гальваническом элементе, дано уравнение зависимости электродвижущей силы Е от температуры (табл.2.)
При заданной температуре Т вычислите электродвижущую силу (Е), изменение энергии Гиббса (), энтальпии (), энтропии (), энергии Гельмгольца () и теплоту (Q), выделяющуюся или поглощающуюся при работе гальванического элемента. Расчет производите для 1 киломоля реагирующего вещества.
Задание 3
Укажите порядок и найдите константу скорости данной реакции, протекающей при заданной температуре Т, пользуясь данными о ходе процесса во времени t с начала реакции (табл.3).
Задание 4
В табл.4 приведены константы скорости k1 и k2 реакции при двух различных температурах Т1 и Т2. Вычислите энергию активации этой реакции при температуре Т3 и определите, сколько вещества прореагировало к моменту времени t, если начальная концентрация вещества С0 (С0 – начальные концентрации реагирующих веществ одинаковые). Определите температурный коэффициент скорости реакции и проверьте применимость правила Вант-Гоффа на примерах. Порядок реакции считать по молекулярности.
Требования к оформлению контрольной работы
При выполнении заданий необходимо использовать литературу, которая приведена в списке используемых литературных источников, материал лекций или другие материалы.
Контрольная работа оформляется по правилам оформления контрольной работы (титульный лист, ответы на теоретические вопросы, расчеты, графики, список использованных материалов).
Список рекомендуемой литературы:
- В.М.Кошкин, Ю.И. Долженко, Физическая химия: что, где, зачем. Программа курса физической химии с аннотированным указателем литературы. Харьков, ХПИ, 2002.
- А.Г.Стромберг, Д.П.Семченко, Физическая химия, М.: ВШ, 2006 г.
- Краткий курс физической химии/ под ред. К.Н.Кондратьева, М.: ВШ, 1978 г.
- В.І.Лебедь, Фізична хімія, Харків, Вид. ХНУ ім.Каразіна, 2006 р.
- Е.В.Киселев, Сборник примеров и задач по физической химии, М.: ВШ, 2002 г.
- Б. А. Веретенченко, Ю.І. Долженко. Лабораторний практикум з фіичної хімії. Частина ІІ. Харків, НТУ «ХПІ», 2002 р.
- Електрохімія. Індивідуальні завдання та методичні вказівки для їх розв’язання для студентів хімічних спеціальностей / Уклад. С.І. Руднєва, Н. В Решетняк. – Х.: НТУ «ХПІ», 2010. 24с.
Таблицы с вариантами заданий
Таблица 1
Таблица 2
|
Таблица 3
| Вариант 1 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| Вариант 2 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| Вариант 3 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| Вариант 4 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| Вариант 5 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| Вариант 6 | |||||||||||||||||||||||||||||||||
|
Реакция: 2H2O2 = O2 + 2H2O
|
|||||||||||||||||||||||||||||||||
| Вариант 7 | |||||||||||||||||||||||||||||||||
|
Реакция: K2S2O8 + 2KI → K2SO4 + I2
|
|||||||||||||||||||||||||||||||||
| Вариант 8 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| Вариант 9 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| Вариант 10 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| Вариант 11 | |||||||||||||||||||||||||||||||||
|
Реакция: C12H22O11 + H2O = C6H12O6 + C6H12O6
|
|||||||||||||||||||||||||||||||||
| Вариант 12 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| Вариант 13 | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
Tаблица 4
| Вари- ант | Реакция | Т1, К | k1 | Т2, К | k2 | Т3, К | t, мин | c0, кмоль/м3 |
| 1 | H2 + Br2 → 2HBr | 574,5 | 0,0856 | 497,2 | 0,00036 | 483,2 | 60 | 0,03 |
| 2 | H2 + Br2 → 2HBr | 550,7 | 0,0159 | 524,6 | 0,0026 | 568,2 | 10 | 0,1 |
| 3 | H2 + I2 → 2HI | 599,0 | 0,00146 | 679,0 | 0,0568 | 648,2 | 28 | 2,83 |
| 4 | H2 + I2 → 2HI | 683,0 | 0,0659 | 716,0 | 0,375 | 693,2 | 27 | 1,83 |
| 5 | 2HI → H2 + I2 | 456,2 | 0,942∙10-6 | 700,0 | 0,00310 | 923,2 | 17 | 2,38 |
| 6 | 2HI → H2 + I2 | 628,4 | 0,809∙10-4 | 780,4 | 0,1059 | 976,2 | 18 | 1,87 |
| 7 | 2NO → N2 + O2 | 1525,2 | 47059 | 1251,4 | 1073 | 1423,2 | 45 | 2,83 |
| 8 | 2N2O → 2N2 + O2 | 986,0 | 6,72 | 1165,0 | 977,0 | 1053,2 | 65 | 1,75 |
| 9 | N2O5 → N2O2 + 1/2 O2 | 298,2 | 0,00203 | 288,2 | 0,475∙10-3 | 388,2 | 32 | 0,93 |
| 10 | PH3 → 1/2 P2 + 3/2 H2 | 953,2 | 0,0183 | 918,2 | 0,0038 | 988,2 | 80 | 0,87 |
| 11 | SO2Cl2 → SO2 + Cl2 | 522,2 | 0,609∙10-4 | 593,2 | 0,132∙10-2 | 688,2 | 35 | 2,5 |
| 12 | KClO3 + 6FeSO4 + 3H2SO4 → 3Fe2(SO4)3 + 3H2O | 283,2 | 1,00 | 305,2 | 7,15 | 323,2 | 39 | 1,67 |
| 13 | CO + H2O → CO2 + H2 | 288,2 | 0,00031 | 312,2 | 0,00815 | 303,2 | 89 | 3,85 |
| 14 | COCl2 → CO + Cl2 | 655,0 | 0,53∙10-2 | 745,0 | 67,7∙10-2 | 698,2 | 104,5 | 0,8 |
| 15 | (CH2)3 → CH3CH=CH2 | 833,2 | 0,00687 | 923,2 | 0,146 | 956,2 | 40 | 1,52 |
| 16 | C2H5ONa + CH3 → C2H5OCH3 + Na | 273,2 | 0,0336 | 303,2 | 2,125 | 288,2 | 10 | 0,87 |
| 17 | CH2(OH)CH2Cl + KOH → KCl + CH2(OH)CH2OH | 297,7 | 0,68 | 316,8 | 5,23 | 303,2 | 18 | 0,96 |
| 18 | CH2ClCOOH + H2O → CH2OHCOOH + HCl | 353,2 | 0,222∙10-4 | 403,8 | 0,00237 | 423,2 | 26 | 0,50 |
| 19 | CH3COOC2H5 + NaOH → CH3COONa + C2H5OH | 282,6 | 2,307 | 318,1 | 21,65 | 343,2 | 15 | 0,95 |
| 20 | CH3COOCH3 + H2O → CH3COOH + CH3OH (в водном растворе катализатор HCl 0,1 N) | 298,2 | 0,653∙10-3 | 308,2 | 1,163∙10-3 | 313,2 | 25 | 1,60 |
| 21 | CH3COOCH3 + H2O → CH3COOH + CH3OH (в водном растворе катализатор HCl 1,8 N) | 298,2 | 16,09∙10-5 | 308,2 | 37,84∙10-5 | 323,2 | 80 | 2,96 |
| 22 | CH3COOC2H5 + H2O → CH3COOH + C2H5OH (в водном растворе катализатор HCl 0,1N) | 273,2 | 2,056∙10-3 | 312,2 | 109,41 | 298,2 | 67 | 3,55 |
| 23 | 2CH2O + NaOH → HCOONa + CH3OH | 323,2 | 5,51∙10-3 | 358,2 | 294,01∙10-3 | 338,2 | 5 | 0,5 |
| 24 | (CH3)2SO4 + NaI → CH3I + Na(CH3)SO4 | 273,2 | 0,029 | 298,1 | 1,04 | 285,8 | 100 | 3,89 |
| 25 | C6H5CH2Br + C2H5OH → C6H5CH2OC2H5 + HBr | 298,2 | 1,44 | 388,2 | 2,01 | 318,2 | 90 | 2,67 |
| 26 | C12H22O11 + H2O → C6H12O6 + C6H12O6 | 298,2 | 0,765 | 328,2 | 35,5 | 323,6 | 15 | 1,85 |